Effects of Downhill Running Exercise on Glucose Tolerance and Skeletal Muscle P-AMPK Expression in Type II Diabetes Rats
Article information
Abstract
OBJECTIVES
The purpose of this study was to investigate the effects of moderate downhill running exercise on glucose tolerance and skeletal muscle phospho-AMP activated protein kinase(P-AMPK) expression in type Ⅱ diabetes rats.
METHODS
8-week-old, 24 wistar & GK rats (type Ⅱ diabetes model) were randomly divided into 4 groups, NR, NE, DR, DE. Downhill running treatment were performed on the treadmill at the -16 % and speed of 16m/min for 1 hour. All groups were done with Oral glucose tolerance test(OGTT) and after 1 week washout period, rats in exercise groups performed downhill running. After exercise treatment, soleus muscle of rats were extracted for test of P-AMPK expression.
RESULTS
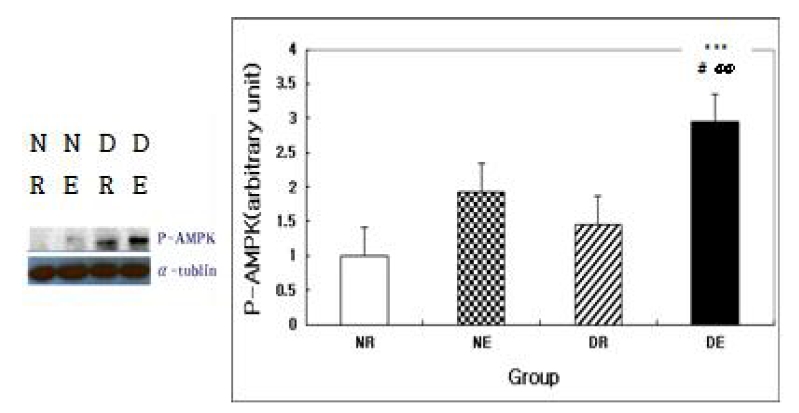
In OGTT, blood glucose levels in all groups were increased after the oral glucose load and these were significantly differ from rest level. But in DE group, blood glucose level at 120 min after OGTT was not significantly differ from rest level. In immunoblotting test for P-AMPK expression of skeletal muscle, NE group was significantly higher than NR group and DE group was significantly higher than other groups.
CONCLUSIONS
Downhill running exercise improved glucose tolerance and increased P-AMPK expression of skeletal muscle in type Ⅱ diabetes rats.
서론
제2형 당뇨는 인슐린 기능 장애인 인슐린 저항성(insulin resistance)으로 인해 발생하며[1], 이 질환에 있어 반복적인 근수축 활동은 인슐린민감도를 높일 뿐만 아니라 이 기전의 경로와 다른 독자적 경로를 통해서도 조직의 포도당 흡수를 증가시켜 고혈당 증상을 완화시킨다 [2-4].
당뇨 환자들에서 신체활동이 포도당 흡수를 증가시키는 기전은 운동에 의해 골격근 내 당수송체의 하나인 GLUT-4 단백질의 발현과 전위가 증가함으로써 글루코스의 세포막 이동과 투과성을 높이기 때문이다[5-8]. 몇몇 연구에서 췌장 β세포 기능이 손상된 실험쥐를 대상으로 운동을 실시한 결과, 인슐린 분비와 무관하게 골격근 내 GLUT-4의 발현이 현저하게 증가함을 보고하였다[9-11].
운동 중 근수축은 글루코스 흡수와 관련한 다양한 단백질 중 AMP activated protein kinase(AMPK)의 활성을 증가시키는 데 크게 기여한다. AMPK는 근수축 에너지인 creatine phosphate, ATP 감소에 의해 활성화되는 에너지 감지기(sensor)로서, 세포내 스트레스 상황에서 근육으로의 포도당 수송과 지방산 산화를 자극하는 것으로 알려져 있다[12]. 몇몇 연구들에서 운동 후 골격근 GLUT-4 발현과 전위가 AMPK 활성 증가에 의해 유도됨을 시사한 바 있다[13-15].
한편, 일상적으로 행하여지는 신체활동은 다양한 방법으로 이루어지는데, 이때의 근수축 형태 또한 다양하다. 일반적으로 평지에서의 걷기, 달리기와 같은 유산소 운동 시 근수축은 구심성 수축(concentric contraction)과 원심성 수축(eccentric contraction)으로 구성되는데, 구심성 근수축이 많은 부분을 차지한다. 그렇지만, 일상생활 중에는 내리막 걷기와 달리기 또는 계단 내려가기 등과 같은 원심성 근수축 형태 또한 빈번하게 발생한다.
몇몇 연구에서 내리막 달리기를 실시하였을 때 인슐린 저항성이 48시간 동안 지속되는 것으로 보고 되었는데[16-18], 그 원인으로 반복적인 원심성 수축으로 인한 근세포 손상이 단핵세포로부터 증가된 tumour necrosis factor-α(TNF-α)의 분비 증가와 이로 인한 IRS-1 인산화와 PI3K의 활성도를 낮춤으로써 인슐린 신호 전달을 억제시킨다고 하였다[19].
당뇨 증상 개선을 위한 운동 효과에 관해 그동안 많은 연구들이 이루어져 왔고, 대체로 중등도의 강도의 운동이 긍정적 효과를 준다는 것이 일치된 결론이었다. 하지만, 제2형 당뇨 모델에서 원심성 근수축 운동이 당내성과 글루코스 흡수에 관여하는 AMPK 단백질 활성에 어떠한 영향을 주는지에 관한 연구들은 거의 없었으며, 따라서 이를 검증할 필요성이 제기되었다.
따라서 본 연구는 제2형 당뇨 쥐에 대한 일회성 내리막 달리기 운동 처치가 당내성과 골격근 AMPK 인산화(phosphorylation)에 어떠한 영향을 미치는 지를 알아보고자 한다.
연구방법
1. 연구대상
본 연구의 실험동물은 제2형 당뇨 모델(SLC Inc. Japan)인 Goto-Kakizaki(GK) rat(age=8 weeks, weight=190.5±20.8 g, n=12)와 대조군으로 Wistar rat(age=8 weeks, weight=244.8±13.9 g, n=12) 24마리를 분양받아 각각 정상휴식군(Normal Rest;NR, n=6), 정상운동군(Normal Exercise;NE, n=6), 당뇨휴식군(Diabetes Rest;DR, n=6), 당뇨운동군(Diabetes Exercise;DE, n=6)으로 무선 할당 및 배정하여 실험 전 일주일 동안 실험실 환경에 적응시켰다. 실험동물은 실험동물용 케이지를 이용하여 사육하였으며, 사육실의 온도는 22-24℃, 습도는 50±10%가 유지되도록 하였다. 실험동물은 시판되는 고형 사료(삼양사, 한국)와 물을 자유롭게 섭취하도록 하였고, 운동처치 12시간 전에 사료를 모두 제거하였다. 조명은 실험동물의 야행성을 고려하여 밤낮 주기(12시간 주/야)가 조절되도록 하였다.
2. 측정 방법
1) 운동처치
운동군의 쥐들은 소형동물용 트레드밀을 이용하며 0% 경사도에서 5m/min 속도로 일일 10분 동안, 3일간의 적응 훈련을 실시하였다. 운동처치 당일 12시간 공복 상태에서 -16 % 경사도에서 16m/min 속도로 1시간 동안 원심성 근수축을 유발시키는 일회성 내리막 달리기 운동을 실시하였고, 휴식군의 쥐들은 같은 시간동안 트레드밀에서 휴식하도록 하였다. 운동강도는 실험 동물 운동강도 설정 방법에 따라 약 VO2max 60-65% 정도의 중강도 운동이었다[20].
2) 경구 당부하 검사 및 골격근 샘플링
실험쥐의 운동 처치가 끝난 후 1시간째에 경구 당부하 검사(Oral Glucose Tolerance Test; OGTT)를 실시하였다. 3차 증류수 1ml에 glucose 0.2mg을 혼합하여 20% 수준의 glucose 용액을 만든 후, 실험쥐의 경구를 통해 kg당 2ml 섭취시킨 후 꼬리정맥으로부터 30분, 60분, 90분, 120분에 각각 채혈하여 혈당 측정기(ACCU-CHEK, Roche Diagnostics, Germany)를 이용하여 측정하였다. 내리막 달리기 운동에 따른 골격근 P-AMPK 발현 정도를 측정하기 위하여 OGTT 실시 후 1주일간의 wash-out periods를 주어 다시 운동처치를 실시하였다. 운동 후 1시간째에 Zoletil 50ⓡ(10 ㎎/㎏, im.: Vibac Laboratories, Carros, France)을 복강 내 주사하여 마취시켰다. 골격근 샘플링은 내리막 달리기에 의한 근손상을 가장 많이 받는 가자미근(soleus)를 적출하였으며(21), 즉시 액화질소로 동결시켜, 분석할 때까지 -70℃에서 보관하였다.
3) western-blot
적출한 근육 샘플 150㎎ 정도를 얼음 접시 위에서 잘게 절단하였다. 근조직을 137mM Nacl, 2,7mM KCl, 10mM Na2PO4, 2mM KH2PO4(pH 7.4)가 함유된 PBS로 씻은 후 50-200㎕의 triton lysis buffer(20mM Tris, pH 7.4, 137mM NaCl, 25mM β-blycerophosphate, pH 7.14, 2mM EDTA, 1mM Na3VO4, 1% Triron X-100, 10% glycerol, 5㎍/㎖ leupeptin, 5㎍/㎖ aprotinin, 3㎛ benzamidine, 0.5mM DTT, 1mM PMSF)에 넣어 초음파 분해하였다. 그 후 각 sample에 대한 단백질을 정량하며, 그 중 10㎍의 단백질을 western analysis에 사용하였다. Membrane protein을 12% SDS-PAGE(1.5M Trizma base, 10% Sodium Dodecyl Sulfate, 30% Acrylamide, 10 Ammonium Sulfate, TEMED) 상에서 전기영동시킨 후 PVDF membrane(Pall Corporation, USA)에 전기 이동시켰다. Antibody와의 비특이적인 결합을 막기 위해 3% BSA, 0.1% Tween 20을 함유하고 있는 TBS buffer에서 membrane을 1시간 동안 상온 반응시키고 4℃에서 16시간 동안 반응시켰다. 반응이 끝난 membrane을 washing 한 후 1차 항체인 rabbit monoclonal antibody(p-AMPK Thr172, Cell signaling, USA)를 Blocking buffer(1X TBS buffer, 3% BSA, 0.1% Tween 20)에 1:1000의 비율로 희석하여 상온에서 30분 동안 반응시켰다. 그 후 membrane을 씻어내고 2차 항체인 HRP conjugated anti-rabbit IgG(Santa Cruz, USA)를 1:1000의 비율로 희석하여 상온에서 30분 동안 처리하고 다시 한 번 씻어내었다. 이후 Membrane에 부착된 단백질을 Western blotting detection system을 이용하여 측정하였으며, densitometer (Sharp jx-330)를 이용하여 스캔한 후, 이미지 분석 프로그램 (Image Master ver. 3.0, Biotech pharmacia)을 통해 P-AMPK 단백질량을 산출하였다.
3. 통계 분석
본 연구의 대상에 대해 내리막 달리기 운동이 당내성과 골격근의 P-AMPK 발현에 미치는 영향을 알아보기 위해 모든 종속 변인들의 집단별 평균(M)과 표준편차(SD)를 구하였다.
내리막 달리기 운동이 당내성에 미치는 영향을 분석하기 위해 처치집단과 채혈시점에 따른 반복측정 분산분석(repeated measured ANOVA)를 실시하였으며, 상호작용효과가 유의한 경우 각 집단내 시점별 사후분석은 대비(contrast) 검증을 시행하였다. 또한 P-AMPK 발현 정도를 분석하기 위하여 일원분산분석(one-way ANOVA)을 실시하였으며, 사후분석은 Tukey HSD를 이용하였다. 유의수준은 .05로 하였다.
결과
1. 내리막 달리기 운동에 따른 당내성
본 연구에서 내리막 달리기 운동이 당내성에 미치는 영향을 분석하기 위한 OGTT 결과치에 대하여 반복측정 분산분석(repeated measured ANOVA)을 실시한 결과(Table 1, Figure 1), 처치집단(P< .001), 채혈시점(P<.001)의 주효과 및 처치집단과 채혈시점간 상호작용효과(P< .05)가 유의한 것으로 나타났다.
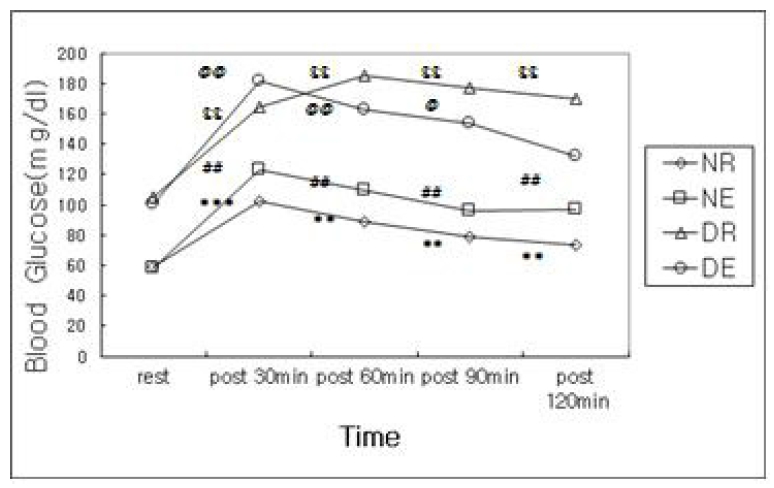
Blood glucose level to group and time
* significant difference with rest value in NR group
# significant difference with rest value in NE group
$ significant difference with rest value in DR group
@ significant difference with rest value in DE group
(Fig. 1)에서 보는 바와 같이, 모든 집단에서 안정시에 비해 OGTT 각 시점에서 유의하게 높은 혈당 수준을 보였지만, DE 집단에서만 OGTT 120분 째에 안정시와 유의한 차이를 보이지 않았다. 또한 NR, NE, DE 집단의 경우, OGTT 30분 째부터 감소하였으나, DR 집단에서는 60분 째 까지 증가하였고, 120분 째까지 비슷한 수준을 유지하였다.
2. 내리막 달리기 운동에 따른 P-AMPK 발현
본 연구에서 내리막 달리기 운동 후 골격근 P-AMPK expression의 변화를 알아보기 위해 실시한 일원분산분석의 결과(Fig. 2), 그룹간 유의한 효과(F=14.057, P=.000)가 나타났다. 이에 대한 사후분석 결과, NE 집단은 NR 집단에 비해 유의하게 높은 수준을 나타내었고, DE 집단은 모든 집단에 비해 유의하게 높은 수준을 나타내었다.
논의
운동은 당뇨 환자의 혈당 수준을 낮춰 증상을 개선시키는데[4,22-24]. 이는 근 수축에 따른 인슐린민감도의 증가와 함께 조직 내 당수송체(GLUT-4)의 세포막 이동 기전을 통한 인체 조직으로의 포도당 흡수 증가에 기인한다. 제2형 당뇨 환자의 증상 완화에 대한 운동중재 연구들은 구심성 근수축 형태의 운동을 처치한 것이 대부분이었다. 운동 방법은 다양하고 일상생활 중의 신체활동 형태 또한 매우 다양하지만, 원심성 근수축이 주로 나타나는 내리막 운동에 따른 혈당 변화에 관한 연구는 드물다.
몇몇 연구에서 고강도 내리막 달리기를 실시한 건강한 일반인에게서 운동전에 비해 48시간 동안 인슐린 민감도가 낮아짐을 보고하였는데[16,17,25], 내리막 달리기 운동은 근섬유가 길어지면서 수축되는 형태로서 근원섬유(myofibril)의 손상과 염증반응이 나타나며, 이는 단핵세포로부터 증가된 tumour necrosis factor α(TNF-α)의 분비 증가로 IRS-1 인산화와 PI3K의 활성도를 낮춤으로써 인슐린 신호 전달을 억제시킨다고 하였다.
본 연구에서는 1시간동안의 내리막 달리기 운동 후 당내성 검사 결과, 모든 집단에서 안정시에 비해 각 검사 시점에서 유의하게 높은 혈당 수준을 보였지만, 당뇨 운동 집단에서는 검사 120분째의 혈당 수준이 안정시와 유의한 차이를 보이지 않았고, 또한 다른 집단과 달리, 당뇨 휴식군에서는 60분째까지 증가하였고, 120분째까지 비슷한 수준을 유지하였다. 결국 당뇨 휴식군에서는 당내성이 감소한 반면, 당뇨 운동군에서는 운동으로 당내성 개선 효과를 가져온 것으로 생각된다.
본 연구 결과는 앞서 언급한 원심성 운동 후 인슐린 민감도 저하를 보였다는 선행연구들[16,17,25]의 결과와 다른 양상으로, 이것은 처치한 운동의 강도 차이에 따른 것이라고 생각된다. 본 연구는 당뇨 동물모델을 대상으로 한 VO2max 60-65%의 중강도 운동인 반면, 위 선행연구들은 VO2max 85%의 고강도 원심성 운동을 실시하였다. 따라서 선행연구들에서 인슐린 민감도가 저하한 것은 고강도 원심성 운동이 근육 조직의 염증 반응을 일으켜 인슐린 신호체계에 영향을 주었지만, 본 연구는 원심성 운동이라 하더라도 중간 정도의 운동 강도였기 때문에 반복적 근 수축이 당뇨 쥐의 근육에서 글루코스의 이용에 긍정적 신호로 작용하였을 것으로 사료된다. 이러한 해석에 시사점을 주는 연구로, 일반인을 대상으로 각각 오르막 걷기와 내리막 걷기를 실시한 후, 당내성 검사를 실시하여 두 집단을 비교한 결과, 두 가지 운동처치 모두 유사하게 혈당 수준이 감소하였다고 보고하였다[26,27]. 이 연구자들은 제2형 당뇨환자와 같이 대사질환이나 심혈관질환이 있는 대상자의 체력 수준을 감안하면 낮은 강도의 내리막 걷기와 같은 운동이 오르막 운동에 비해 보다 쉽게 장기간 효율적으로 활동할 수 있는 운동 형태라고 분석하였다.
근육에서 에너지 감지-신호전달 (energy sensingsignaling)의 역할을 하는 AMPK는 근섬유의 ATP 고갈을 방지하기 위한 탄수화물과 지방 대사에 관여하며[12,28,29], 운동은 조직 내 AMPK의 활성화를 통해 제4형 당수송체(GLUT-4)를 세포막으로 이동시켜 포도당의 조직 흡수를 증가시키는 것으로 알려져 있다[13].
제2형 당뇨를 가진 환자 또는 동물 모델을 대상으로 한 연구들[30-32]에 따르면, 인슐린과는 독립적으로 운동을 통해 AMPK 활성화가 GLUT-4 세포막 전위를 증가시켜 글루코스 흡수를 촉진시킨다고 하였으며, 일반인과 제2형 당뇨군의 사이클 운동에 따른 AMPK 활성을 분석한 연구에서 두 집단 간 유사하게 나타난다고 보고하였다[13].
본 연구에서는 제2형 당뇨 쥐를 대상으로 일회성 내리막 달리기 운동처치를 했을 때, 골격근 AMPK 활성화 수준을 대변해 주는 AMPK 인산화 정도를 평가한 결과, 정상 운동 집단은 정상 휴식 집단에 비해 유의하게 높은 수준을 나타내었고, 당뇨 운동 집단은 모든 집단에 비해 유의하게 높은 수준을 나타냄으로써 운동으로 인해 AMPK의 활성이 증가하는 현상을 보였다. 본 연구의 결과는 운동에 의한 반복적인 근수축이 AMPK 활성을 증가시킨다는 선행연구들의 결과[30-32]와 일치하며, 원심성 근수축이 수반되는 중강도의 내리막 달리기 운동에 의해서도 AMPK의 활성이 증가될 수 있음을 확인하였다.
향후 당내성 변화와 포도당 흡수 기전에 대한 내리막 운동의 장기간 트레이닝 효과, 내리막 운동의 다양한 운동강도 효과 그리고 연령별 변화 차이 등을 규명하는 후속 연구들이 이루어져야 할 것으로 본다.
결론
본 연구의 목적은 제2형 당뇨 쥐를 대상으로 내리막 달리기 운동이 당내성과 골격근의 AMPK의 인산화에 미치는 영향을 분석하는 것이다. 그 결과 다음과 같은 결론을 얻었다.
첫째, 1시간동안의 내리막 달리기 운동 후 OGTT 결과, 모든 집단에서 안정시에 비해 OGTT 각 시점에서 유의하게 높은 혈당 수준을 보였지만, DE 집단에서는 OGTT 120분째에 안정시와 유의한 차이를 보이지 않았다. 따라서 제2형 당뇨 쥐의 내리막 달리기 운동은 당내성을 개선한 것으로 보인다.
둘째, 제2형 당뇨 쥐를 대상으로 내리막 달리기 운동 처치를 했을 때, 골격근 AMPK 활성화 수준을 대변해 주는 P-AMPK 발현 정도를 평가한 결과, 정상 운동 집단은 정상 휴식 집단에 비해 유의하게 높은 수준을 나타내었고, 당뇨 운동 집단은 모든 집단에 비해 유의하게 높은 수준을 나타냄으로써 운동으로 인해 P-AMPK 발현이 증가하는 현상을 보였다.
따라서, 중강도의 일회성 내리막 달리기 운동은 제2형 당뇨 쥐의 당내성을 개선시키고, 골격근의 AMPK 활성을 증가시켜 당뇨 증상 개선에 기여하는 것으로 확인되었다.
Notes
The authors declare no conflict of interest.