ěëĄ
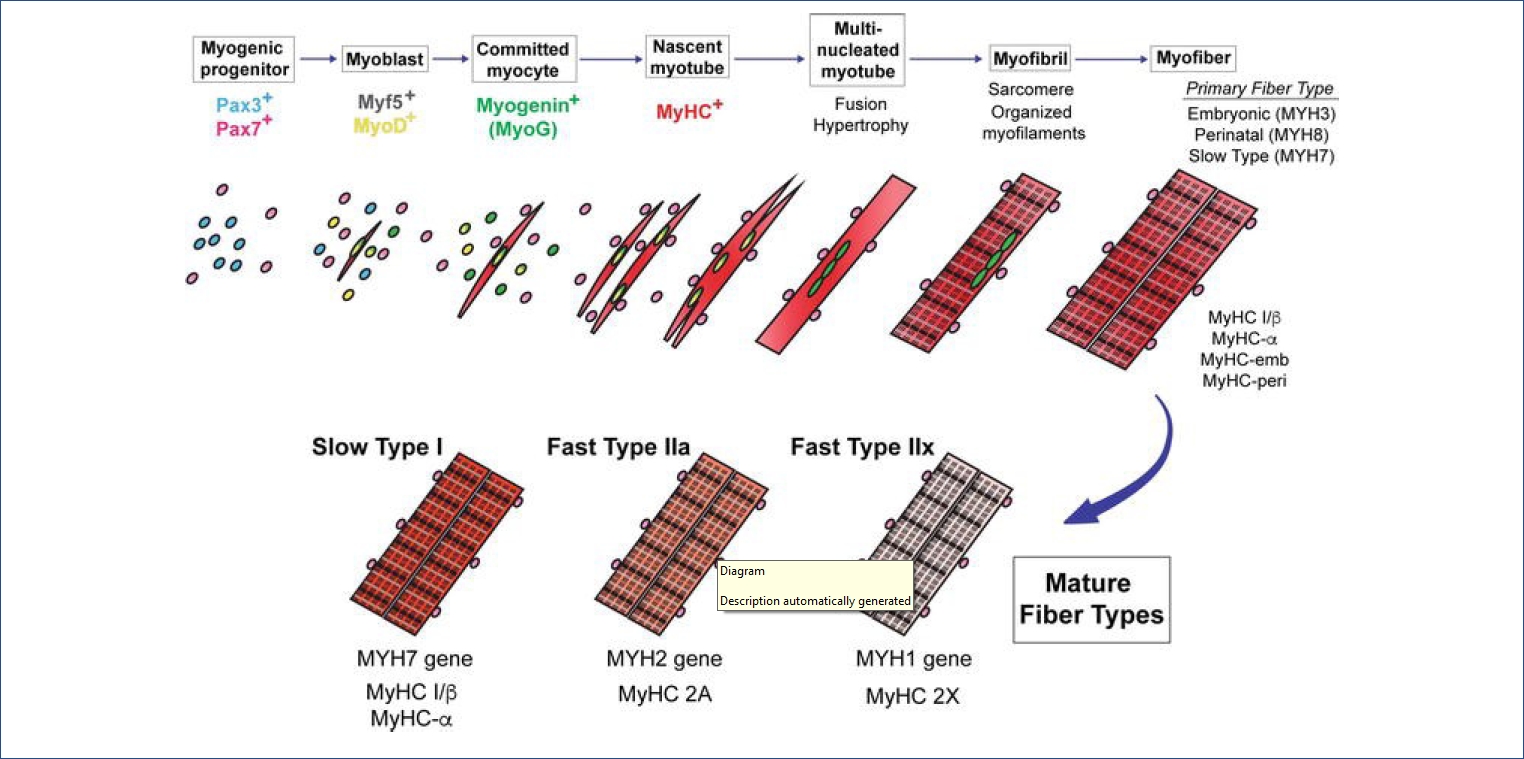
모ë ě§íľě¸íŹë ěĄí´ëŻ¸ě¤ě ě¤íŠě˛´ëĽź ę°ě§ęł ěě´ ě체ě ěźëĄ ěě§ěź ě ěë¤. ꡟěĄě¸íŹë ë¤ëĽ¸ ě¸íŹě ë¤ëĽ´ę˛ ěĄí´ëŻ¸ě¤ě ęľě°¨ę˛°íŠęłź ěĄí´íëźëŠí¸ě ěŹëźě´ëŠěźëĄ íšě´ě ě¸ ěěśëĽë Ľě ę°ëë¤. ꡟěĄě¸íŹë 골겊ꡟě¸íŹ(skeletal muscle cell), ěŹęˇźě¸íŹ(cardiac muscle cell), ííꡟě¸íŹ(smooth muscle cell), ęˇ¸ëŚŹęł ęˇźěíźě¸íŹ(myoepithelial cell) 4ę°ě ë˛ěŁźëĄ ëë ě§ë¤. ě¤ë°°ě˝ěě ě ëëë ꡟěĄě¸íŹ(골겊ꡟě¸íŹ, ěŹęˇźě¸íŹ, ííꡟě¸íŹ)ë ꡟěĄě 기ëĽęłź 꾏쥰 ë° ë°ëŹęłźě ě´ ëŞ¨ë ěě´íë¤. 골겊ꡟ ě¸íŹë ě¸íŹěľíŠěźëĄ ë¤íľ 꾏쥰뼟 íěąíęł ęˇ¸ ě¸ ęˇźěĄě¸íŹë ë¨íľ 꾏쥰ě´ë¤. 골겊ꡟě¸íŹě ěŹęˇźě¸íŹë ꡟě ě´ëź ëśëŚŹë ěěś ë¨ěę° ęˇěšě ěźëĄ ë°°ě´ëě´ ěě´ ě¤ëŹ´ëŹę° ëíëęł , ë´ěĽěĄ°ě§ě ěŁźëĄ ëśíŹëě´ ěë ííꡟ ě¸íŹë ꡟě ě ëśęˇěší ë°°ě´ëĄ ě¤ëŹ´ëŹë ëł´ě´ě§ ěë íšě§ě ëł´ě¸ë¤. ě¸ë°°ě˝ěě ě ëë ꡟěíź ě¸íŹë ěŹě ííëĄ ë°ëŹëě§ ěęł , ěíźě ę˛°íŠ ěĄ°ě§ ííëĄ ěĄ´ěŹíë¤. ëí ě ě, 욨ě, ě ě ě ěíźěě ěĄě˛´ëĽź ë°ŠěśíëëĄ ëęą°ë íěąě íěĽęˇźěźëĄ ěěś íëě íë¤[1].
Myocilin (MyoC)ě ě´ě ę°ě ěíźě¸íŹ, ě 경ě¸íŹ, ě ě , ęł í ëą ë돟 쥰ě§ěě íëę˛ ë°íëęł ęł¨ę˛Šęˇź ěąěĽě ě ëíë ě¸íŹ 경ëĄě ę´ë ¨ě´ ěěźëŠ°[2], ě꾏ëżë§ ěëëź ěŹěĽ, 골겊ꡟ, ě, ę°ěě , 골ě, íě , ě 댽ě , ěěĽ ë° ę˛°ěĽ, í, ěˇěĽ, ęł í, ëě, ě˛ě, 댟íě ë° ëśě ěě ëŽě ë°íěě ëł´ěěźëŠ°, ë, íë°, ę°, ě ěĽ, ëšěĽ ë° ë°ąí꾏ěěë ë°íëě§ ěë ę˛ěźëĄ ěë ¤ě ¸ ěë¤[3].
ě§ě ęˇ¸ëŚŹęł ěě ěźëĄ ęą´ę°í 골겊ꡟě íěąě ěí´ěë ěľě ě ě 체 íëě ěí ě¸íŹë 벨ěěě ě í¸ ě ëŹě˛´ęłëĽź ěë ę˛ě´ íěě ě´ëźęł ë í ě ěë¤. 본 댏롰ě 몊ě ě ě체ě ěě´ě 골겊ꡟě ęą´ę° íěąë뼟 ëě´ę¸° ěí´ íí ěë ¤ě ¸ ěë ě¸íŹë 벨ěěě 기ě ě ëí´ ëŹ¸íęł ě°°ě íľí´ íě¸í¨ęłź ëěě 골겊ꡟě ęą´ę° íěąëě ěě´ě íší ěꡟ ë°íě ę´ë ¨ě´ ěě´ ëł´ě´ë MyoCě ěí ęˇ¸ëŚŹęł ę¸°ěĄ´ě ěë ¤ě§ ęł¨ę˛Šęˇźě ěě ë° ě§ě íĽěęłź ě°ę´ë ě¸ěë¤ě ę´ë ¨ěąě ëí´ ěěëł´ë ę˛ě ěë¤. 본 댏롰ë íší ě¤ëŤëě ě꾏ěě ë
šë´ěĽęłź ę´ë ¨íěŹ ë§ě ě°ęľŹë¤ě´ ëł´ęł ë MyoCę° ęł¨ę˛Šęˇźě¸íŹ ëśíě ꡟěŹě íě
ě 쥰ě íë ě ěŹě ě¸ěëĄě ꡟě íěąě ě´ë¤ ěí ě íęł ěëě§ě ꡸ě ë°ëĽ¸ MyoC ěěŠ ę˛˝ëĄě ëí´ ěĄ°ěŹëł´ęł ě íë¤.
ꡟěĄě¸íŹ ëśíě ę´ë ¨ë ě¸ěě MyoC
골겊ꡟě ěě§ě, ěě¸ě ě§, í¸íĄ ëąě ěě´ íěě ě´ë¤[4]. 골겊ꡟ ëśíë ěŹëŹ ě ěŹě¸ěě ěí¸ěěŠěźëĄ ě´ëŁ¨ě´ě§ëŠ°, ꡟěě¸íŹ(myoblast)ě ěŚěě´ ě¤ě´ë¤ëŠ´ě ě¸íŹëިěě´ íěĽëęł ěľíŠíěŹ ěŹëŹ ę°ě íľě ëł´ě í ꡟěŹě ëĄ ë°ëŹí늰 ěąěęłźě ě ęą°ěł ëšëĄě ꡟěěś ëĽë Ľě ę°ëë¤[5]. ě§ę¸ęšě§ ěë ¤ě§ ęˇźě¸íŹ ëśí ě¸ěëĄë Myogenic regulatory factor (MRF)ě Myocyte enhancer binding factor (MEF)ę° ěë¤. ęˇźěĄ ě 꾏ě¸íŹěě MyoD, Myogenin (MyoG), Myf5, Mef2ě ę°ě ě ěŹě¸ěë¤ě p38/MAPK, Wnt, Sonic hedgehog (Shh) 경ëĄëĄ ë°íëęł , bone morphogenetic protein (BMP)ě Notch/Delta 경ëĄę° ěľě ë늴ě ꡟěŹě ëśíę° ěĄ°ě ëë¤[6].
ꡟę´ěźëĄě ë°ëŹ ęłźě ě ë ë˛ě í° ëłí뼟 ęą°ěšë¤ <Figure 1>. ěźě°¨ ꡟę´(primary myotube)ě ě´ę¸° ꡟěě¸íŹę° ěľíŠí늴ě ꡟ깴(muscle tendon)ěŹě´ě ë°°ě´íęł , ěźě°¨ ęˇźę´ í늴ěě ěŚěíë í기ë¨ęłě ꡟěě¸íŹę° ěľíŠë늴ě ě´ě°¨ ꡟę´(second myotube)ě´ íěąëë¤. ě´ ě기ě ě´ë ë´ë°ě ěśě(motor-neuronal axon)ě´ ě 경 ě§ë°°ëĽź í늴 ëšëĄě ꡟěĄěźëĄěě íšě§ě ě¸ ěěś ę¸°ëĽě ę°ëë¤[7].
ě´ ěě ěě ë¤ěęłź ę°ě ë ę°ě§ íě
ě 미ě¤ě ě¤ěę° ěěąëë¤; ě§ęˇź(slow-twitch type I)ęłź ěꡟ(fast-twitch type II). ěźě°¨ ęˇźę´ íěą ě기ěë ëëśëś Type I ěŹě ę° ěěąëęł [9] ꡟë°ěęłźě íę¸°ě¸ ě´ě°¨ ęˇźę´ íěą ě기ěë Type II ěŹě ę° ë°ëŹíë¤[10]. Ratě ëě ꡟěĄě¸íŹě¸ L6 ꡟěě¸íŹě ęˇźę´ ëśí ě¤íěě ěę¸°ëł ë°íëë 1170ę°ě ë¨ë°ąě§ě 체ęłě ěźëĄ ëśěí 결곟, ęˇ¸ě¤ 379ę°ě ë¨ë°ąě§ě´ ꡟěě¸íŹěě ꡟę´ěźëĄ ëśííëë° ěě´ě ě¤ěí 기ëĽě íë ę˛ěźëĄ ëł´ęł ëěë¤[11].
ꡟěĄě 기ëĽě 결ě íë ꡟěŹě íě
꾏ěąëšë ěźë°ě ěźëĄ ë°°ě ꡟë°ě(embryonic myogenesis)ě기ě ě ě ě ěí´ ě í´ě§ë¤ęł ëłź ě ěěźë íěíě ěźëĄ íí´ě§ë ě´ëě íí ëë ě§ëł ě 돴ě ěí´ ěŹě íě
꾏ěąëšę° ëŹëźě§ë¤. ꡸ëŹë, ě§ę¸ęšě§ ꡟěŹě íě
꾏ěąëšě ěíĽě 죟ë ě ěŹě ěě¸ë¤ě´ 돴ěě¸ě§ 꾏체ě ěźëĄ ěë ¤ě ¸ ěě§ ěęł ěë¤.
ꡟě¸íŹ ë°ëŹě´ ěěë늴ě ëśëšëë MyoCę° ęˇźě¸íŹ ëśíě ę´ë ¨ěąě´ ěëě§ ěĄ°ěŹí´ëł¸ ě°ęľŹę° ěëë°, MyoCë ě¸íŹ ěŚěęłź ě쥴ě 쥰ě íęł [12] MyoG, myosin heavy chain2 (MYH2)ě í¨ęť ëśí ě´ę¸°ě ë°íë¨ě´ íě¸ëěë¤[13]. ꡟëšë ëŠěť¤ëěŚě íě¸í기 ěí ë ë¤ëĽ¸ ě°ęľŹěě Rat골겊ꡟě¸íŹě IL8ě ě˛ëŚŹíě ë ꡟě¸íŹ ëśíě ěě´ě MyoC ë°íě´ ę°íëěë¤[14]. ě´ë ꡟě¸íŹ ěŚěëł´ë¤ë ꡟ ëśíě MyoCę° ě°ę´ëě´ ěěě ěěŹíë¤. ë ëěę° MyoCę° ęˇźě¸íŹ ë°ëŹě ěě´ ě íí 경ëĄě íší ěŹě íě
ë°ëŹě ě§ě ě ě¸ ěíĽě 죟ëě§ íě¸í´ëłź íěę° ěë¤. 본 ě°ęľŹě§ě ě§í ě¤ě ěťě ěźëś 결곟ě ë°ëĽ´ëŠ´, MyoC ě ě ě ë°íě ěľě íěě ë(knock-down) Fast-twitch type II ě ě ě(MYH1, MYH2, MYH4) ë°íě´ ě¤ě´ë¤ěęł , ë°ëëĄ ęłźë°í(overexpression) ěěź°ě ë Slow-twitch type I (MYH7) ě ě ěě Fast-twitch type II ě ě ě ë°íě´ ěŚę°ëë 결곟뼟 íě¸í ě ěěë¤. ě´ëŹí 결곟ë 미ě¤ě íěąęłźě ě MyoCę° ę´ěŹíęł ěěě ěěŹí늰, íěŹë ꡸ 경ëĄëĽź íě¸íęł ěë¤. ěľęˇźě ě°ęľŹě ěí늴 MyoCë transforming growth factor-β (TGF-β) ě í¸ ę˛˝ëĄě ěíĽě 죟ë ě˘
ěěľě ë¨ë°ąě§ CAV1 (Caveolin-1) 결íŠíěŹ C2C12 cell (mouse myoblast) ëśíě ę´ěŹí¨ě´ ëł´ęł ëěë¤ [13]. ꡟě¸íŹ ëśíë Mammalian target of raphamycin (mTOR) [15], TGF-β[16], Notch[17] ëą ë¤ěí ě í¸ ě ëŹ ę˛˝ëĄě ę´ěŹëë¤ęł ěë ¤ě ¸ ěë¤. ě´ëŹí ëł´ęł ě ꡟ깰íěŹ MyoCë ꡟě¸íŹ ëśíě ę´ěŹíęł ěěźëŠ° ꡟě¸íŹ íě
ěë ěíĽě ëźěšë¤ęł ěśě ëë¤.
골겊ꡟě ě ěě ëłíě ěě´ěě 미ě¤ě (Myosin)
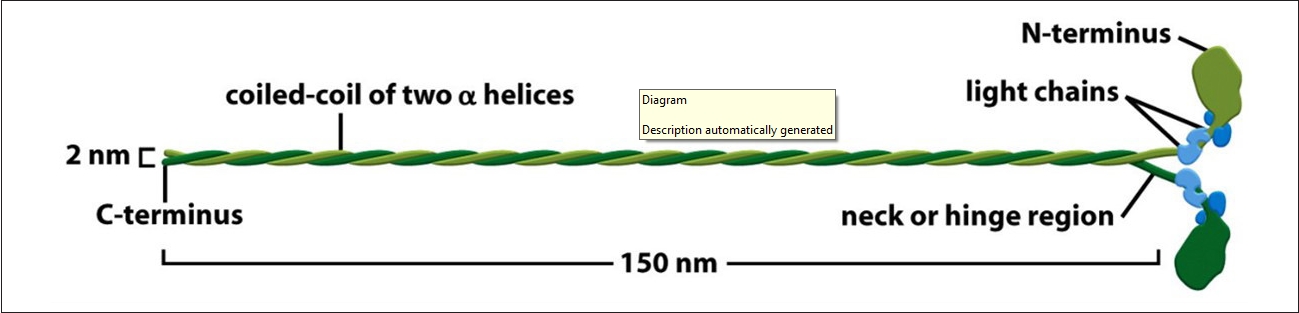
ěĄí´ ę¸°ë° ëŻ¸ě¤ě ë¨ë°ąě§ ëłľíŠě˛´ë 모ë ꡟěĄě¸íŹ ë° ëšęˇźěĄě¸íŹěě ě¸íŹ ěě§ěě ě¤ěí ěěě´ëŠ°, Myosin heavy chain (MHC)ë ꡟěĄě 기ëĽ, ěąěĽ, ë°ëŹě íľěŹ ě¸ěě´ë¤. ěľęˇźë¤ě´ 골겊ꡟ íěą ęłźě ě ě´í´í기 ěí ě°ęľŹę° íë°ě´ ě´ëŁ¨ě´ě§ęł ěëë°, 골겊ꡟ ëśí ěę¸°ëł ë°íëë ë¨ë°ąě§ ëśěě ě¸íŹë´-ě¸íŹę° ě í¸ ě ëŹ ęłźě ęłź ë¨ë°ąě§ íŠěą ë° ëśí´, ë¨ë°ąě§ ě í, ě¸íŹ ëśě°Š ë° ě¸íŹě¸ 기ě§, ě¸íŹ 꾏쥰 ë° ě´ëěą, ëěŹęłźě , ě¸íŹě기ę´ě ě´ë ëąě ě´í´íëë° íěě ě´ëŠ°[5], ě´ě ę´ë ¨íěŹ ęˇźěĄě¸íŹě 미ě¤ě 꾏쥰뼟 보늴 ë¤ěí¨ě ě ě ěë¤. 골겊ꡟě Slow-twitch type Iě¸ ě§ęˇź 미ě¤ě ě¤ě(MHC-I)ě Fast-twitch type IIě¸ ěꡟ 미ě¤ě ě¤ě (MHCs, MHC-IIa, -IId/IIx, IIbëą)ëĄ ęľŹëśëë¤[18]. Myosin IIë <Figure 2>ěě ëł´ě´ë ë°ě ę°ě´ 2ę°ě 꾏í 머댏ě 2ę°ě ęźŹëŚŹę° ěęł , ꟏댏ëśëśě 미ě¤ě ëśěě ě´ě¤ęźŹě ęľŹěĄ°ëĄ ëě´ ěë ę˛ě ě ě ěë¤[19].
ꡟěě¸íŹ ě´ę¸° ëśí ë§ěť¤ě¸ MyoDę° slow type â
ëł´ë¤ fast type â
Ąěě ë ë§ě´ ë°íëë ę˛ě íě¸íěęł ë¨ë°ąě§ 기ě ě 돴 ě¤íěě glycolytic fiber typeě´ ë ě´ě§ë¨ě íě¸íěë¤[20]. Type â
Ą fiberë glycolytic enzymeě´ íëśíęł ëš ëĽ¸ ěěś íšěąě ę°ě§ęł ě§ęł ěě´ ěëě§ ě´ěŠě¨ě´ ëš ëĽ´ë¤[21]. ě´ëęłź ę´ë ¨ë Glass ě¸(2005) ě°ęľŹě ë°ëĽ´ëŠ´, ě´ëęłź ëíěěŠě ꡟěĄëě ěŚę°ěí¤ëë° ë돟 ěąě˛´ěěě ꡟëšëë íĽëŻ¸ëĄę˛ë ꡟěŹě ě ě ěŚę°ëźę¸° ëł´ë¤ë ꡟěŹě íŹę¸° ěŚę°ě ę´ë ¨ ěë¤ęł ëł´ęł íěë¤[22].
기ęłě ě¤í¸ë ěš ěꡚě 죟ěě ë ěěąëë Phospholipase D (PLD)ë ëźíë§ě´ě (rapamycin)ęłź 경ěě ěźëĄ mTOR뼟 íěąíěěź ęˇźěĄë ěŚę°ëĄ ě´ě´ ě§ě ëł´ęł íěěźë[23], ě ě°ě ě´ëěźëĄ ě ëëë ꡟěĄě ěŚę° ë° ëěŹ ęłźě ě ě íí ěë ¤ě ¸ ěě§ ěë¤. íší ęł ę°ë ě´ëěźëĄ ě¸í ęˇźěĄ ę°íë ě ě§ëěŹ ë° ě§ëł ěë°Šě í¨ęłźě ě´ëźë ě°ęľŹ ę˛°ęłźę° ęłěí´ě ë°íëęł ěěźëŠ°, ęł ę°ë ě ě°ě ě´ëě ěí´ěë Trim63, Fos, Col1a1 and Six2 ě ě ěę° ěĄ°ě ëë ę˛ěźëĄ ëł´ęł ëěë¤[24]. ęł ę°ë ě´ëěźëĄ ꡟě ě ěŹě íě
ě íě íěě ě¸ ěěë¤ě´ <Figure 3>ě˛ëź ě ě ëŞ
íí ë°íě§ęł ěë¤[25]. ě´ě ę´ë ¨íěŹ, ěśíěë ě´ë¤ ííě ě´ëě´ ěëě§ ě´ěŠě¨ě´ ëě Fast type fiber ë°ëŹě í¨ęłźě ě¸ě§ ěěëłź íěę° ěę˛ ë¤.
ꡟěŹě íě íěąě ěě´ ě¤ěí mTOR/S6K1 Pathway
ě¸íŹ ěąěĽęłź ëśě´ě ë¨ë°ąě§, ě§ě§, ęˇ¸ëŚŹęł íľě° ěě°ě ěí ëíěěŠęłź ě´ëĽź ëśí´ěí¤ë ě´íěěŠě´ ëěě ěźě´ë늴ě ęˇ íě´ ě ě§ëěź ëěŹ íěěąě´ ě´ëŁ¨ě´ě§ë¤[26]. ě´ëŹí ęłźě ě´ íë°íę˛ ě´ëŁ¨ě´ě§ęł ěë 골겊ꡟě ě 체ě ěě§ěęłź ěąěĽëżë§ ěëëź ě ě§ëěŹě íľěŹ ěěëĄ ě¸ěëęł ěë¤[27]. íší, 골겊ꡟě ěě´ě ěěą ęłźě ě mTOR, FoxO, NF-kB ë° Î˛-catenin ě í¸ę˛˝ëĄëĽź íľíěŹ ě´ëŁ¨ě´ě§ě´ ěë ¤ě ¸ ěë¤[22]. ěľęˇź mTOR ě í¸ě ëŹ ě˛´ęłë ꡟëšë ë° ęˇźěě¤ě 쥰ě í¨ěźëĄě¨ ęˇźěĄ íěěąě ě ě§íë 경ëĄëĄ ę´ěŹě´ ě§ě¤ëęł ěë¤. mTORě ěąěĽě¸ěě ěěě ëą ě¸ëś ě í¸ě ë°ëź ë¨ë°ąě§ íŠěąě íŹí¨í ë¤ěí ëěŹ ęłźě ě ě ě´íë ě¸íŹ ěąěĽęłź ëěŹ ěĄ°ě ěëĄ ěë ¤ě ¸ ěë¤. mTORë mRNA ě ěŹ ęłźě , íľě°, ë¨ë°ąě§, ě§ě§ íŠěą ë° ëśí´ě ę´ěŹíěŹ ě¸íŹě ěąěĽęłź ě¸íŹëěŹ ë° ě§ëłě ě´ëĽ´ę¸°ęšě§ ꡸ ěí ě´ ë¤ěíë¤[26]. mTORë PI3K-related kinase(PIKK) ꡸룚ě ěí늰 ě¸ëŚ°/í¸ë ě¤ë ë¨ë°ąě§ ě¸ě°íí¨ě(kinase)ëĄ mTOR Complex1 (mTORC1)ęłź mTOR Complex2 (mTORC2) ëłľíŠě˛´ę° 쥴ěŹíë¤. mTORC1ě ě´ ëŞ¨ë ęłźě ě 쥰ě íë ě¤ěě¸ěě´ëŠ° 늴ěěľě ě ě¸ ëźíë§ ě´ě ęłź ꡸ ě ěŹě˛´ě ę° mTORě ěľě ěí¤ë ě ěŹě íě ěšëŁ ěěŠě ëĄ ěľęˇź ę°ę´ë°ęł ě기ë íë¤[28]. mTORC1 ę¸°ě§ ě¤ p70S6 Kinase1 (S6K1)ęłź elF4E Binding Protein (4EBP)ě ě¸ě°í ęłźě ě ęą°ěł ë¨ë°ąě§ íŠěąě 쥰ě íë 돟ě§ě¸ë°[28], ꡟěĄě mTOR, S6K1ě 4E-BP1 (eukaryotic initiation factor 4E-binding protein) ě í¸ ě ëŹëĄ 쥰ě ëë¤[29]. S6Kë 2ę°ě ëí체 p70/p85 S6K1, p54/p56 S6K2ę° ěĄ´ěŹíë¤[30]. S6K ëí체ë 꾏쥰ě ěëěąě´ ëěě ěźë°ě ěźëĄ ëšěˇí 기ëĽě íě§ë§ ěľęˇź ě°ęľŹě ěí늴 ëë ˇíę˛ ë°ë 기ëĽě ëíë´ę¸°ë íë¤[31]. ęł ę°ë ě íěą ě´ë í AMPK, S6K1 ě¸ě°íę° ěŚę°íęł 4E-BP1ě¸ě°íë ę°ě í ěŚę°í늰, mTOR íě ë¨ęłě ěë S6K1ě´ ęł ę°ë ě íěą ě´ë í Type Iëł´ë¤ Type IIěě ě¸ě°íę° ëěą ěŚę°í ę˛ě íě¸íěë¤[32]. ꡟěŹě íě
ě´ ěěŹ ěë ꡟěĄě ě´ë í ë°íëë AMPK íěąě ěí´ ěŹě ě íě´ ě íë늰 ꡟěĄě ě§ ëí ëŹëź ě§ ě ěë¤[33].
KEGG (Kyoto Encyclopedia of genes and genomes) ë°ě´í°ë˛ ě´ě¤ë ěë ¤ě§ě§ ěě ě¸íŹë ě 기체ě 기ëĽě ë°í기 ěí´ ę´ěŹěë ě ě ě ë ëęˇëި ëśě뼟 ëśěí ě ěë íëĄęˇ¸ë¨ě´ë¤. ꡟë¨ë°ąě§ ë°íęłź ę´ë ¨ë ëśěě 경ëĄëĽź íě¸í기 ěíěŹ KEGG Mapper뼟 íěŠíěŹ ě§ę¸ęšě§ ë°íě§ mTORę´ë ¨ ě í¸ě ëŹě˛´ęłëĽź ě ěíěë¤<Figure 4>[34].
골겊ꡟě ę°ěěąęłź MyoC
MyoCë ëí ě¤í
뼨 ëě¤ě˝ëě(D. discoideum) MHCě 77.6% ěëěąě ę°ě§ëŠ°, ěŹěĽ β-MHCě 25% ěëěąě´ ěë¤ęł ěë ¤ěĄë¤[35]. ě´í MyoCě ę´í ě°ęľŹë 결íŠěĄ°ě§ěěě 꾏쥰ě ěí ě íęł ěěě íě¸íěěźë ě í¸ě ëŹ ëŹźě§ëĄěë ěě§ ëŞ
íí ěë ¤ě ¸ ěě§ ěěë¤. 미ě¤ě ęłź ěí¸ěěŠíë MyoCë ě¸ě꡸돟 ě¸íŹ(trabecular meshwork cell)ě 미ě¤ě 쥰ě 경ě(myosin regulatory light chain, RLC)ě ěí¸ěěŠíë ę˛ěźëĄ ěë ¤ě ¸ ěěźëŠ°[36], Dystrophin associated protein complex (DAPC)ě 결íŠíěŹ ęˇźě¸íŹ ëśí뼟 ě ëíë ę˛ěźëĄ ěë ¤ě§ MyoC뼟 ęłźë°íěí¨ ě ě ě ëłě´ ěĽěě Akt, mTOR, FoxO3 ě ěŹě¸ě ě¸ě°íę° ěŚę°ëęł ęˇźëšëę° ěźě´ë¨ě íě¸íěë¤[37]. ꡟěĄëšë 쥰ě ěě¸ MyoCë ě¸ëśě ěźëĄ Dystrophin subunitě¸ ěí-ě ëëĄí(Îą-syntrophin)ęłź 결íŠí¨ě íě¸íěë¤ [38]. Lynch ě¸(2018)ě ě°ęľŹě ë°ëĽ´ëŠ´ ëłě´ ë§ě°ě¤ěě MyoCë 15ë°° ęłźë°íëěęł ëëľ 40%ě ëšëłľęˇź ëšë뼟 ëł´ęł íěë¤. ę˛ë¤ę° ëłě´ ë§ě°ě¤ě ꡟě ěě M band ííę° MyoC 결íŠěźëĄ ꡸ ęľŹěĄ°ę° ę°íëěěě íě¸íěë¤[39]. ě´ę˛ě íë˛ íěąë ëšëłľęˇź ěŹě ę° ě˝ę˛ ëśí´ëě§ ěěě ěěŹíë¤. ěľęˇźě ë¤ě´ěěź MyoCę° ě체ë´ě Tetramer, Octamer, Cleaved or Dimer ëą ~20/30ěě >300kDa íŹę¸°ęšě§ ë¤ěí ëśě ííëĄ ěĄ´ěŹí¨ě íě¸íěë¤[40]. ëí MyoCë ě ěŹě¸ě MEF2c-Dependent íěë¨ęł ě¸ěëĄě ěë°ě ě ë ęˇźěĄ ěě¤ęłź ě
ěĄě§(Cachexia) íěě ꡟěĄěě MyoC ë°íěě´ ę°ěí¨ě íě¸íěë¤[41]. ě´ ę°ě´ë° Myocyte enhancer-binding factor 2c (MEF2c)ë ęˇźěĄ ěĽě , ě, ě ę˛˝ęł ě§ëł, ěŹěĽëłěěë 골겊ꡟ ëšë ęłźě ě ěëíë ě ěŹě¸ěëĄ PI3K/AKT, p38 MAPK, Wnt signalingě ę´ěŹíë¤[42].
결ëĄ
ꡟěŹě íšěąě 미ě¤ě 꾏ěąęłź ě´ě ë°ëĽ¸ ěŹě íě
, ëěŹ ëŠěť¤ëěŚ, ěšźě íěěą ëą ě¸íŹ 꾏쥰ëżë§ ěëëź ę¸°ëĽě ě¸ ëŠ´ ëą ëłľíŠě ě´ë¤. ꡸ëŹë ꡟěŹě íě
ě ę´í ě ě ě ë°í í¨í´ ë° ě ěŹě¸ěě ě ě´ ę´ë ¨ ěěë¤ě ěě§ęšě§ë ꡸ ěí ë¤ě ëí´ě ëŞ
ííę˛ ě 댽ëě§ ěęł ěë¤. 본 댏롰ë 첍째, ęłźęą° ëł´ęł ë ě°ęľŹëĽź íľíěŹ MyoCę° ęł¨ę˛Šęˇź ě¸íŹ ëśíě ěíĽě 죟ë ě¸ěěě íě¸íęł , MyoC Tg ě¤íěě ëšëłľęˇź ě¸íŹ ꡟě ě M band íí뼟 ę°íěěź fast type ěŹě ěě ꡸ í¨ě ëě´ ëěě íě¸í ě ěěë¤[39]. ë째, ꡟ ëšë ęłźě ě¤ ęˇźě¸íŹ íě
íěąě ěíĽě ě¤ë¤ęł ěŹę˛¨ě§ë MyoC ěěŠęłźě ě íľí´ PI3K/AKT/MEF2c/MyoC/mTOR/p70S6K/S6ě 경ëĄëĽź ë¤ěęłź ę°ě´ ěśě í ě ěěë¤<Figure 5>. ě
째, ě´ëě ꡟěĄěěąě ě ëíë ě¤ěí íëě´ë¤. ꡟëšë뼟 쥰ě í ě ěë ě´ëě íí, ę°ë, ëšë, ěę° ëąě ë°ëĽ¸ MyoC ë°íěŹëś, ęˇ¸ëŚŹęł ěěŹ ěëě§ ě´ěŠí¨ě¨ě´ ëě fast type fiber íěą ě ë, ęˇ¸ëŚŹęł ě´ëĽź íěŠí ě ěë ě체 ë°ěě ě¸ëśě ě¸ ëśëĽě ëí´ěë ěěźëĄ ě´ëŁ¨ě´ě ¸ěź í ěëĄě´ ě°ęľŹ ěěě´ëź í ě ěę˛ ë¤.